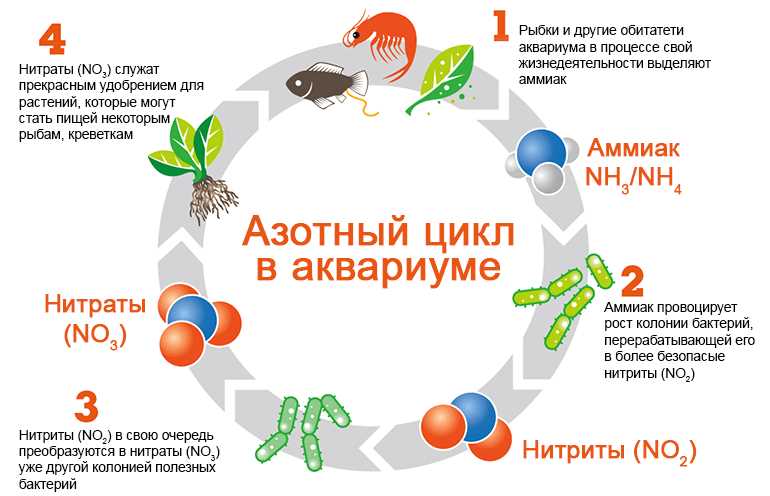
Когда мы слышим слова «аммиак» и «аммоний», мы часто считаем их синонимами. Однако, на самом деле, эти два термина обозначают разные вещества с разными свойствами и применениями.
Аммиак — это химическое вещество с формулой NH3. Оно является газообразным и имеет резкий и неприятный запах. Аммиак широко используется в производстве удобрений, чистящих средств, а также в промышленности для охлаждения и холодильных систем.
Аммоний — это соединение, состоящее из атомов азота и водорода, обычно обозначаемое формулой NH4. В отличие от аммиака, аммоний является ионом и часто присутствует в солевых соединениях. Аммоний используется в медицине, сельском хозяйстве, а также в производстве препаратов для удаления красок и стирающих средств.
Таким образом, хотя аммиак и аммоний могут иметь некоторые общие свойства, они имеют разные структуры и применения.
Что такое аммоний?
Аммоний (NH4+) хорошо растворим в воде и широко используется в различных сферах жизни, включая сельское хозяйство, медицину, производство химических соединений и технологических процессов.
Вот несколько интересных фактов о аммонии:
- Аммоний является ключевым компонентом для растительного питания. Он является источником азота, который растения используют для своего роста и развития.
- Аммоний также используется в производстве удобрений. С помощью аммонийных соединений сельское хозяйство улучшает плодородие почвы и повышает урожайность растений.
- В медицине аммоний используется в виде аммоний хлорида и других соединений для лечения определенных состояний, таких как кашель, заложенность носа и заболевания печени.
- Аммоний также играет важную роль в промышленных процессах. Он используется для очистки воды, производства пищевых добавок, производства стекла и тканей, а также для регулирования pH в косметических изделиях.
Таким образом, аммоний является важным химическим соединением, которое находит широкое применение в различных сферах жизни. Он играет роль как питательное вещество для растений, так и ключевой ингредиент в медицине и производстве. Разнообразие его использования делает его важным компонентом нашей повседневной жизни.
Свойства аммония
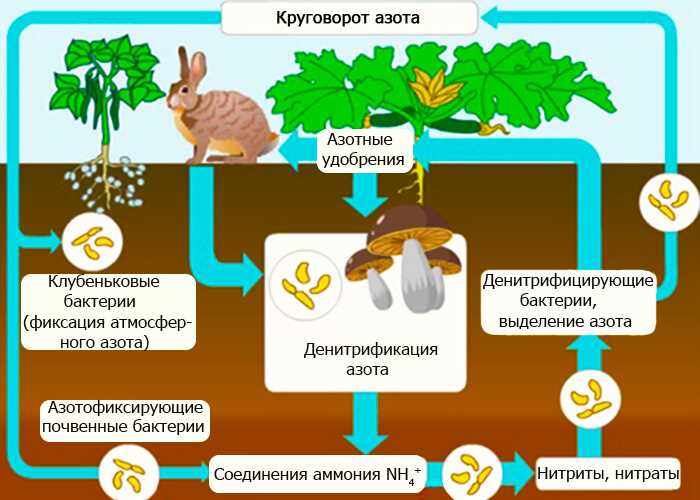
1. Аммоний — щелочное соединение. Оно образуется в результате реакции аммиака (NH3) с кислотой. Когда аммиак вступает в контакт с кислотой, происходит образование ионов аммония (NH4+), которые обладают щелочными свойствами.
2. Аммоний — сильное удобрение. Ион аммония является основным источником азота для растений. Азот является одним из важнейших элементов, необходимых для роста и развития растений. Аммонийное удобрение способствует повышению урожайности и качества сельскохозяйственных культур.
3. Аммоний — ингредиент бытовых и промышленных продуктов. Аммонийные соединения широко используются в производстве моющих средств, моющего мыла, шампуней и других бытовых и косметических продуктов. Они способны эффективно очищать и дезинфицировать поверхности.
4. Аммоний — консервант пищевых продуктов. Некоторые соединения аммония используются в пищевой промышленности в качестве консервантов для продуктов, чтобы продлить их срок годности.
5. Аммоний — часть искусственных удобрений. Ионы аммония входят в состав многих искусственных удобрений, которые широко применяются в сельском хозяйстве.
6. Аммоний — токсичное соединение. В чистом виде аммоний обладает токсичными свойствами и может вызывать раздражение глаз, кожи и дыхательных путей. Поэтому при работе с аммонием необходимо соблюдать меры предосторожности и использовать средства индивидуальной защиты.
Применение аммония
1. В сельском хозяйстве:
- Аммоний является основной составляющей азотных удобрений, которые применяются для повышения урожайности почвы. Высокое содержание азота в аммонии способствует росту растений и улучшению их качества, увеличивая урожайность.
- Другим важным применением аммония в сельском хозяйстве является его использование в качестве заживляющего средства при различных заболеваниях растений. Аммоний обладает антисептическими свойствами, позволяя бороться с болезнями и дефектами растений.
2. В производстве:
- Аммоний широко используется в процессе производства пластмасс, например, полиэтилена и полипропилена. Эти материалы востребованы во многих отраслях, таких как строительство, автомобильная промышленность и упаковка.
- Промышленные товары, такие как удобрения, дезинфицирующие средства и препараты для чистки, также содержат аммоний в своем составе.
- Аммоний используется в процессе коагуляции и обеззараживания воды. Он образует осадок, который может удалять из воды различные вредные примеси, делая ее безопасной для употребления.
3. В быту:
- Аммиак, который получают из аммония, является основным компонентом многих моющих средств и чистящих красителей, которые используются в хозяйстве. Он эффективно удаляет жир, пятна и другие загрязнения.
- Аммоний также применяется в качестве запахоуничтожителя. Его приятный запах дает чувство свежести и чистоты в доме.
Аммоний является незаменимой составляющей в многих сферах нашей жизни, от сельского хозяйства до производства и быта. Его использование способствует росту урожайности, обезвреживанию воды, производству пластмасс и многому другому. Благодаря аммонию мы можем наслаждаться высококачественными продуктами, чистой водой и уютным домом. Как вы можете видеть, аммоний играет важную роль в нашей повседневной жизни и окружающей среде.
Что такое аммиак?
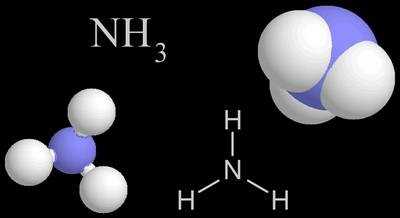
Аммиак обладает резким, дразнящим запахом и широко используется в промышленности. Он находит применение в производстве удобрений, а также служит сырьем для получения различных химических соединений, включая нитраты, ацетон и многие другие.
Кроме того, аммиак может быть использован в бытовых целях, например, для очистки стекол, удаления запахов или как аммиачная сода при приготовлении пищи. Однако в таких случаях важно быть осторожным, так как аммиак является вредным веществом и может вызывать раздражение дыхательных путей и глаз.
- Признаки аммиака:
- Запах
- Первая буква в алфавите
- Используется в промышленности
- Используется в сельском хозяйстве для производства удобрений
- Является основанием для получения химических соединений
Аммиак можно получить различными способами, одним из которых является габер-бошевский процесс — важный индустриальный процесс, использующийся для получения аммиака по каталитическому способу.
В целом, аммиак является важным химическим соединением с широким спектром применения в различных отраслях промышленности и бытовой сфере.
Свойства аммиака
1. Запах
Одним из самых характерных свойств аммиака является его отталкивающий запах. Возможно, вы замечали неприятный запах при открывании бутылки с очищающими средствами или при посещении некоторых чистильных учреждений. Это именно запах аммиака. Запах аммиака можно ощущать уже при его очень низкой концентрации в воздухе.
2. Растворимость в воде
Другое важное свойство аммиака — его высокая растворимость в воде. Аммиак может легко смешиваться с водой, образуя аммиачную воду. Это позволяет использовать аммиак в различных целях, таких как очищение, химические процессы и синтез различных соединений.
3. Базическость
Аммиак является слабым основанием. Он образует оксониевые соли (соли аммония), когда взаимодействует с кислотой. Такое взаимодействие может происходить в водных или органических растворах. Базические свойства аммиака делают его полезным в качестве щелочи в процессах обработки и синтеза различных соединений.
4. Ядовитость
Аммиак является токсичным веществом и может быть вредным для здоровья человека при высоких концентрациях. При вдыхании аммиака возможны раздражение глаз, носа и горла, а также проблемы с дыханием. Поэтому необходимо быть осторожным при работе с аммиаком и обращаться с ним в соответствии с предписаниями безопасности.
5. Использование
Из-за своих уникальных свойств аммиак широко используется в различных областях. Он применяется в сельском хозяйстве в качестве удобрения для повышения плодородия почвы. Аммиак также используется в производстве удобрений, пластмасс, химических веществ и многих других продуктов.
Благодаря этим свойствам аммиак является одним из наиболее полезных и важных соединений. Он играет важную роль в различных отраслях промышленности, сельском хозяйстве и быту. Однако, не забывайте о безопасности и правильном обращении с этим веществом.
Применение аммиака
1. Удобрения
Аммиак является одним из ключевых компонентов в производстве удобрений. Источником азота для растений служит аммоний и его производные, которые получают из аммиака. Удобрения на основе аммония вносятся в почву, чтобы обеспечить растения необходимыми питательными веществами, такими как азот.
2. Производство пластиков
Аммиак играет важную роль в производстве пластиков. Он используется в качестве сырья для создания различных полимеров, таких как полиэтилен и нейлон. Эти полимеры широко применяются в производстве упаковки, пластиковых бутылок, пленки и других продуктов пластиковой индустрии.
3. Производство промышленных химикатов
Аммиак является важным сырьем для производства различных химических веществ. Он используется в производстве азотной кислоты, карбамидной смолы, нитроглицерина и других взрывчатых веществ. Кроме того, аммиак применяется в производстве моющих средств, специальных растворов и промышленных отбеливателей.
4. Холодильные системы
Аммиак также используется в системах охлаждения и кондиционирования воздуха в промышленности. В таких системах он действует как рабочее вещество, перенося тепло и обеспечивая охлаждение. Использование аммиака в холодильных системах является эффективным и экологически безопасным вариантом.
5. Очистка воды
Аммиак используется в процессах очистки воды. Он применяется для удаления загрязнений, таких как азотные соединения и некоторые токсические элементы. Аммиак помогает поддерживать экологическую безопасность водных ресурсов и обеспечивает безопасность для живых организмов в водной среде.
6. Производство красителей и пигментов
Аммиак используется в производстве красителей и пигментов. Он помогает усилить яркость и интенсивность цвета в красках, чернилах и косметических продуктах. Аммиак также используется для регулирования pH-значения в процессе производства красителей.
7. Ветеринария
Аммиак широко применяется в ветеринарии. Он используется для дезинфекции животноводческих помещений и средств передвижения животных. Аммиак эффективно уничтожает бактерии и другие патогенные микроорганизмы, способствуя сохранению здоровья животных.
8. Производство батарей
Аммиак находит применение в производстве различных типов батарей. Например, он используется в никель-металлогидридных (NiMH) аккумуляторах для увеличения энергоемкости и обеспечения длительной работы устройств.
9. Металлургия
Аммиак используется в металлургической промышленности для обработки металлических поверхностей и удаления окислов, а также для получения металлов, таких как никель и кобальт. Он применяется в качестве восстановительного и дезоксидирующего агента.
Это лишь несколько примеров применения аммиака. Его широкий спектр использования подтверждает его важность в различных отраслях и индустриях. Надеюсь, что данная информация помогла вам лучше понять значение аммиака в современном мире!
Различия в структуре молекул
Аммоний (NH4+) — это положительный ион, состоящий из азота (N) и четырех атомов водорода (H). Он образуется в результате ионизации аммиака (NH3) — неорганического соединения азота и водорода. Аммоний широко используется в многих областях, включая аграрную и фармацевтическую промышленность, а также в химических лабораториях.
Аммиак (NH3) — это вещество, состоящее из одного атома азота и трех атомов водорода. Аммиак является бесцветным газом с характерным резким запахом. Он в основном используется в промышленности, сельском хозяйстве и в качестве холодильного средства. Аммиак также широко применяется в производстве удобрений.
Таким образом, различие в структуре молекул аммония и аммиака заключается в количестве атомов водорода, которые связаны с атомом азота. Аммоний имеет четыре атома водорода, в то время как аммиак имеет три атома водорода.
Сравним структуру молекул аммония и аммиака:
| Аммоний (NH4+) | Аммиак (NH3) |
|---|---|
| Атом азота (N) | Атом азота (N) |
| Атом водорода (H) | Атом водорода (H) |
| Атом водорода (H) | Атом водорода (H) |
| Атом водорода (H) | |
| Атом водорода (H) |
Таким образом, структура молекулы аммония отличается от структуры молекулы аммиака, прежде всего количеством атомов водорода, связанных с атомом азота.
Надеюсь, что эта информация помогла вам понять различия в структуре молекул аммония и аммиака. Если у вас возникли еще какие-либо вопросы, не стесняйтесь задавать их!
Реактивность и токсичность аммония и аммиака: в чем разница?
Давайте разберемся в разнице между аммиаком и аммонием, касающейся их реактивности и токсичности. Эти два химических соединения могут вызывать интерес и одновременно вызывать озабоченность в своих различных применениях.
1. Аммиак
Аммиак, намного известнее нам в повседневной жизни, является безцветным газом с характерным резким запахом. Он часто используется в промышленности для производства удобрений, пищевых добавок и синтетических материалов.
Важно отметить, что аммиак является реактивным веществом. Это означает, что он может быстро взаимодействовать с другими веществами, образуя новые соединения. Иногда аммиак может быть опасным, если используется неправильно или несоблюдены соответствующие меры безопасности.
2. Аммоний

Аммоний, с другой стороны, является ионом, полученным от аммиака путем присоединения водного раствора. В отличие от аммиака, аммоний не является газообразным соединением, а представляет собой соль, растворимую в воде.
Аммоний также широко используется в различных областях, включая промышленность, медицину, сельское хозяйство и технологические процессы. Он может применяться в качестве животноводческих добавок, средств для чистки, удобрений и консервантов.
Реактивность и токсичность
В контексте реактивности и токсичности, аммиак и аммоний имеют различные свойства и характеристики.
Аммиак:
- Реактивность: аммиак является сильным основанием и может реагировать с кислотами, образуя соли.
- Токсичность: аммиак является токсичным для организмов при высоких концентрациях. Вдыхание высоких уровней аммиака может вызвать раздражение дыхательных путей и увеличить риск развития заболеваний легких.
Аммоний:
- Реактивность: аммоний считается менее реактивным по сравнению с аммиаком, так как он уже находится в ионной форме.
- Токсичность: аммоний по сравнению с аммиаком обычно менее токсичен для организмов. Он может быть более безопасным для использования, но, как и с любым химическим соединением, необходимо соблюдать предосторожность и следовать рекомендациям по безопасному использованию.
В зависимости от конкретного применения и условий использования, как аммиак, так и аммоний могут иметь свои достоинства и недостатки. Важно правильно воспользоваться этими соединениями и соблюдать указанные инструкции и меры предосторожности для обеспечения безопасного использования и предотвращения нежелательных последствий.
Разница между аммонием и аммиаком
- Химическая формула: Аммиак имеет формулу NH3, в то время как аммоний имеет формулу NH4+.
- Окислительное состояние азота: В молекуле аммиака азот имеет окислительное состояние -3, в то время как в молекуле аммония азот имеет окислительное состояние +3.
- Форма: Аммиак является газообразным соединением при комнатной температуре и давлении, а аммоний обычно находится в виде солей.
- Роль в химических реакциях: Аммиак используется часто в промышленности и сельском хозяйстве как удобрение и в производстве различных химических соединений. Аммоний является основным ионом, найденным в аммиачных солях, и может участвовать в реакциях обмена ионов.
- Токсичность: Аммиак является ядовитым газом, который может вызывать раздражение дыхательных путей и глаз. Аммиачные соли, содержащие аммоний, также имеют токсичный потенциал, но в меньшей степени, чем газообразный аммиак.
В целом, аммиак и аммоний являются различными формами соединений азота и водорода, с разными физическими и химическими свойствами, а также различными ролями в химических реакциях и применениях.





